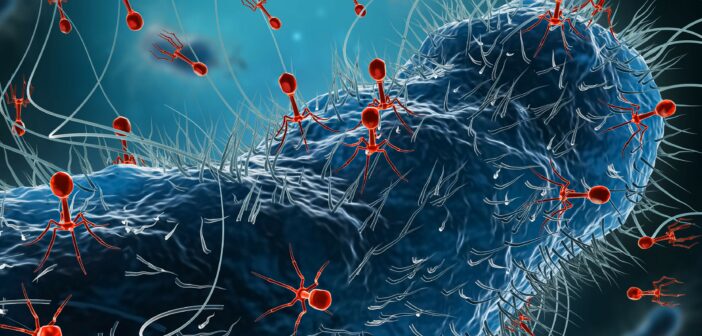
A szív- és érrendszeri betegségek mögött egy eddig alábecsült szereplő is állhat: a baktérium. A fertőzések nemcsak rontják a szív állapotát, de akár el is indíthatják a problémát. De mi történik akkor, ha az antibiotikumok csődöt mondanak? Meglepő módon egy vírus lehet a megoldás – a fágterápia újraírhatja a gyógyászat jövőjét, írja a Magyar Kardiológusok Társasága.
A WHO legfrissebb adatai szerint az antibiotikum-rezisztens fertőzések évente több mint 1,27 millió ember haláláért felelősek világszerte – és a szám folyamatosan emelkedik. Egyre több baktérium válik ellenállóvá a korábban hatékony gyógyszerekkel szemben, ezzel hatalmas kihívás elé állítva az orvosokat. A hagyományos antibiotikumos kezelések sokszor már nem jelentenek megoldást, különösen azoknál a betegeknél, akiknél a szív is érintett.
A WHO szerint nem elég új antibiotikumokat fejleszteni – teljesen új szemléletre van szükség. Az egyik legígéretesebb alternatíva a fágterápia, amely képes lehet ott is hatni, ahol más módszerek kudarcot vallanak.
A bakteriofág – vagy röviden: fág – egy olyan vírus, amely baktériumokat fertőz meg és pusztít el. A felfedezése több mint száz évre nyúlik vissza, mégis csak most kezd visszakerülni az orvosi köztudatba. A nyugati világban az antibiotikumok háttérbe szorították a fághasználatot, ám a Szovjetunióban, különösen Grúziában, tovább folyt a kutatás. Az Eliava Intézet ma is a világ egyik legnagyobb fággyűjteményének ad otthont.
A fágterápia legnagyobb előnye, hogy célzottan pusztítja el a kórokozókat, miközben az emberi sejteket érintetlenül hagyja. Ez különösen fontossá válik akkor, ha a fertőzés a szív közelében jelentkezik – például beültetett eszközök esetén.
A bakteriofágokról röviden
A bakteriofágok – vagy röviden fágok – a világ legelterjedtebb biológiai entitásai: ezek a vírusok baktériumokat fertőznek meg, és elképesztő számban fordulnak elő bolygónkon. Tudományos becslések szerint a Földön jelenleg mintegy 10³¹ darab fág található, vagyis ezermilliárdszor ezermilliárdszor tízmilliárd példány – egy olyan szám, amely meghaladja az összes csillag számát a megfigyelhető univerzumban. A fágok nemcsak lenyűgöző mennyiségük, hanem ökológiai szerepük miatt is figyelemre méltók: a tengeri ökoszisztémákban például kulcsszerepet játszanak a bakteriális populációk szabályozásában, a tápanyagkörforgásban és a genetikai anyag horizontális átvitelében. Egyetlen csepp tengervízben több millió fág található, és naponta hozzávetőleg 10²³ baktériumot pusztítanak el világszerte – ezzel folyamatosan alakítják a mikrobiális világ szerkezetét. A bakteriofág specificitása pedig azt jelenti, hogy a fág csak azokat a baktériumokat képes fertőzni, amik hordozzák a receptorokat, amikhez kötődni képes. Ezért lehet nagyon ígéretes módszer, hiszen minden mást „békén hagy”, tehát csak az adott kórokozóval szemben brutális, minden mással kíméletes.
Sokáig úgy gondoltuk, a szívbetegségek kialakulásáért főként életmódbeli tényezők és genetika felelős. Ma már tudjuk, hogy a krónikus gyulladások, sőt egyes fertőzések is komoly kockázatot jelentenek. A fogágybetegségek például nemcsak a száj egészségét veszélyeztetik: a baktériumok bejuthatnak a véráramba, és megtapadhatnak a szívbelhártyán vagy a szívbillentyűkön. Ezt az állapotot infectív endokarditisznek hívják.
De nem ez az egyetlen út. A szájüregi gyulladások fokozhatják az érelmeszesedés kockázatát, a véráramfertőzések – például a szepszis – pedig maradandó károsodást is okozhatnak a szívizomban vagy a billentyűkön. A szervezet folyamatos, alacsony szintű gyulladásban tartható akár a szájban, akár a belekben vagy a tüdőben. Ez hosszú távon megnöveli a szívinfarktus és a stroke esélyét.
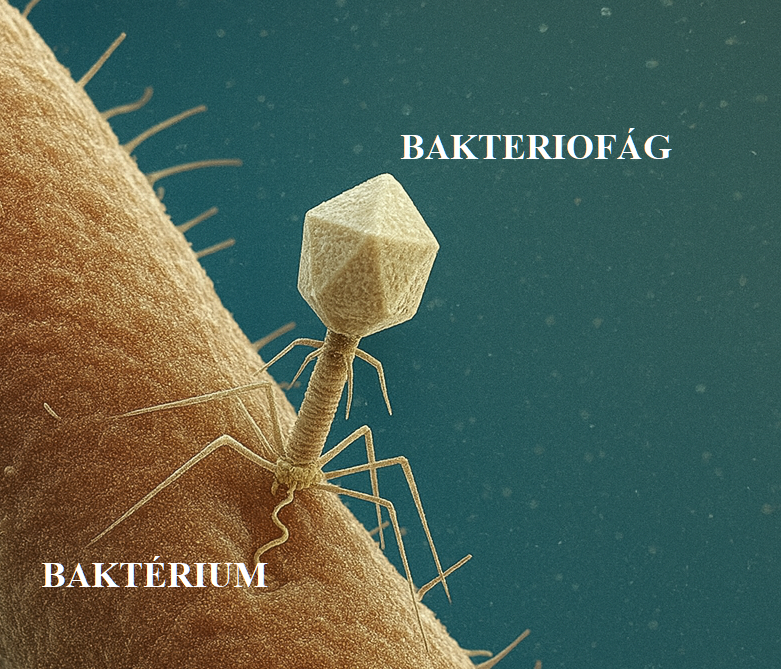
Így nézne ki, ha megrajzolnánk a bakterofágot, amint épp landol egy baktérium felszínén és bejuttatja a saját örökítőanyagát. Mire emlékeztet minket ez a forma? A Mátrixban az űrhajót támadták meg hasonló dolgok 🙂 / Forrás: Magyar Kardiológusok Társasága
A modern orvostudomány szerint az érelmeszesedés valójában krónikus gyulladásos folyamat – amelyet a bélflóra állapota is befolyásol. Egyes bélbaktériumok olyan anyagcseretermékeket termelnek, mint a TMAO (trimetil-amin-N-oxid), amelyek gyulladást idéznek elő az érfalakban. Ez hozzájárul a plakkok kialakulásához és felszakadásához, amelyek szívinfarktushoz vagy agyvérzéshez vezethetnek.
A „gut-heart axis”, vagyis a bél-szív kapcsolat a kutatások egyik legforróbb területe. Az is felmerült, hogy a bélbaktériumok összetételének megváltoztatásával – például fágterápiával – csökkenteni lehetne a szív- és érrendszeri betegségek kialakulásának esélyét.
A pacemakerek, érprotézisek és szívműbillentyűk életmentő technológiák, mégis új fertőzési kockázatot hoznak magukkal. Ezek az eszközök ideális felszínt biztosítanak a biofilmképző baktériumok számára. A biofilm egy védő nyálkaréteg, amely megakadályozza, hogy az antibiotikumok elérjék a baktériumokat – így a fertőzés tartóssá, nehezen kezelhetővé válik.
A gyulladás, láz vagy akár szepszis kialakulása gyakran csak az eszköz eltávolításával kezelhető, ami sok esetben életveszélyes. A fágok viszont képesek áthatolni ezen a védőrétegen, és célzottan elpusztítani a biofilm belsejében megbúvó kórokozókat.
A szívtranszplantáción átesett betegek immunrendszerét gyógyszerekkel gyengítik, hogy elkerüljék a szerv kilökődését. Ez azonban súlyosan megnöveli a fertőzések kockázatát. Ha egy ilyen beteg antibiotikum-rezisztens baktériummal találkozik, a következmények akár végzetesek is lehetnek.
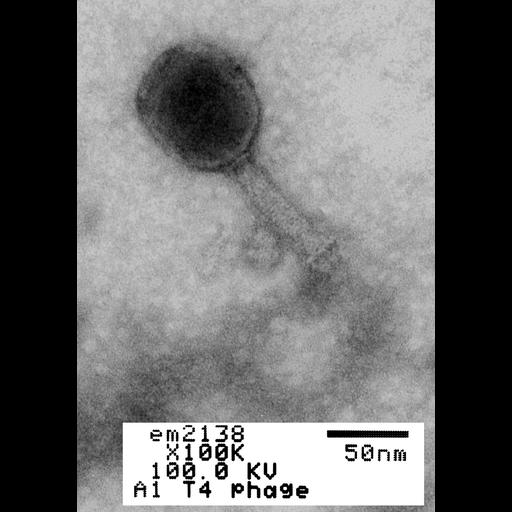
Így néz ki valójában. A kép forrása: Louisa Howard (2012) CIL:41125, Enterobaktériumok fág T4. CIL. Adatkészlet. https://doi.org/doi:10.7295/W9CIL41125 / Forrás: Magyar Kardiológusok Társasága
A hosszú távú antibiotikum-használat nemcsak a baktériumflórát boríthatja fel, hanem újabb fertőzéseket is kiválthat, és károsíthatja a beültetett szerv működését. A fágterápia ebben az esetben is célzott megoldást kínál: kíméletes a mikrobiomhoz, és egyre több transzplantált beteg esetében alkalmazzák sikerrel.
A fágterápia a jövő orvoslásának egyik legígéretesebb iránya: teljesen személyre szabott. Minden beteg számára egyedi fágkoktélt készítenek, amely pontosan az őt megbetegítő baktériumtörzs ellen hatásos. A kezelés lehet folyadék, kapszula vagy intravénás infúzió formájában is.
A fágokat hűtve kell tárolni, és előállításuk rendkívül szigorú laboratóriumi feltételeket kíván. Az engedélyeztetés is bonyolult, mivel gyakorlatilag minden fág „egyedi gyógyszernek” számít. Emellett etikai és jogi kérdések is felmerülnek: ki vállalja a felelősséget egy kísérleti terápia mellékhatásaiért? Hogyan szabályozható egy nem standardizált, hanem személyre szabott eljárás?
A kérdés azonban ma már nem az, hogy használhatjuk-e a fágeket. Hanem az, hogy mikor és hogyan illesztjük be őket biztonságosan és hatékonyan a mindennapi gyógyításba.
Forrás: MTK